製品・安全性 よくあるご質問
- ここに掲載のQ&Aは、医療従事者向けの内容です。
- この情報は、製品の適正使用に関する参考情報であり、あらゆるケースに適応されるものではありません。
従いまして、 Q&Aの利用によって生じた結果については、責任を負いかねますのでご了承ください。なお、製品のご使用に当たっては、最新の電子添文/添付文書をご確認ください。 - 製品に関してご不明な点がございましたら、弊社お問い合わせ窓口又は弊社担当MRにお問い合わせください。
エイベリス / エイベリスミニ
効能・効果
作用機序について教えてください。
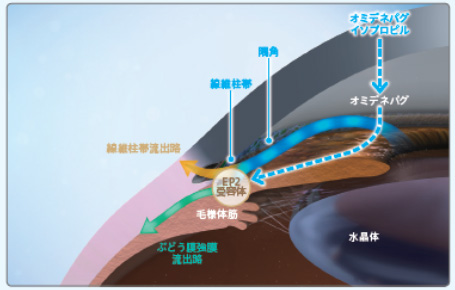
エイベリス点眼液・エイベリスミニ点眼液の主成分であるオミデネパグ イソプロピル(OMDI)はプロドラッグです。点眼後、角膜中で速やかに活性代謝物であるオミデネパグ(OMD)に代謝されます。OMDはEP2受容体に対して選択的に結合し、その刺激により、線維柱帯流出路及びぶどう膜強膜流出路を介して房水流出を促進し、眼圧下降作用を示すと考えられています1)。
- 参考資料
-
- 1)Fuwa M. et al.:J. Ocul. Pharmacol. Ther. 34,531(2018)【66031】
[2023/05 更新]
エイベリス点眼液とエイベリスミニ点眼液の効能・効果に違いはありますか?
エイベリス点眼液、エイベリスミニ点眼液の効能・効果は、いずれも「緑内障、高眼圧症」です。
ただし、エイベリスミニ点眼液については、電子添文25. 保険給付上の注意に記載の通り、「以下の患者に使用した場合に限り算定するものであること。①ベンザルコニウム塩化物に対し過敏症の患者又はその疑いのある患者、②角膜上皮障害を有する患者」とされていますので、ご注意ください。
[2023/05 作成]
用法・用量
用法は1日1回点眼ですが、どの時間帯に点眼すればよいですか?
エイベリス点眼液・エイベリスミニ点眼液(エイベリス類)を点眼する時間帯に特に決まりはありません。異なる時間帯に点眼して眼圧下降効果を比較検討した試験は行っておらず、点眼する時間帯によって効果に差がみられるかは明らかではありません。
なお、国内臨床試験はすべて夜(21時)点眼しましたが、眼圧測定を行った投与後20時間まで有意な眼圧下降作用が認められました1)。このことから、エイベリス類の1日1回点眼により1日を通じた眼圧下降作用が期待でき、朝点眼においても同様の眼圧下降作用を示すと考えられます。
点眼を忘れないよう、患者さんのライフスタイル等を考慮して点眼時刻を設定してください。
エイベリス類では一過性の結膜充血があらわれる場合があり、日中の充血を軽減するために夜点眼するというのもひとつの方法です2)。
- 参考資料
-
- 1)エイベリス点眼液/エイベリスミニ点眼液 インタビューフォーム Ⅵ-2.-(3) 作用発現時間・持続時間の項
- 2)エイベリス点眼液/エイベリスミニ点眼液 適正使用ガイド 6 ■注意を要する副作用 結膜充血 Expert’s Opinion
[2023/05 更新]
特殊背景患者
無水晶体眼又は眼内レンズ挿入眼の患者さんに禁忌である理由を教えてください。無水晶体眼、眼内レンズ挿入眼とは白内障手術を受けた眼のことですか?
エイベリス点眼液の国内臨床試験において、安全性解析対象となった総症例267例のうち、14例(5.2%)で嚢胞様黄斑浮腫を含む黄斑浮腫の副作用が認められました。黄斑浮腫はいずれも眼内レンズ挿入眼において認められ、安全性解析対象症例のうち眼内レンズ挿入眼における発現割合は26.9%(14/52例)でした。エイベリス点眼液・エイベリスミニ点眼液(エイベリス類)をこれらの患者さんに投与した場合、黄斑浮腫が発現する可能性が高いことから禁忌としています1)。
無水晶体眼、眼内レンズ挿入眼とは白内障手術を受けた眼のことですか?白内障手術を受けた患者さんはすべて投与禁忌ですか?
その通りです。白内障手術は白く濁った水晶体を除去する手術で、多くの患者さんは水晶体の代わりに視力を矯正するために眼内レンズを挿入します(眼内レンズ挿入眼)。
水晶体を支えるチン氏帯が脆弱などの理由で眼内レンズの挿入が難しい患者さんでは、無水晶体のまま眼鏡等で矯正されることもあります。
なお、片眼のみ白内障手術を受けている患者さんで、その対側眼にエイベリス類を投与することも禁忌に該当しますので、投与は避けてください2)。
- 参考資料
-
- 1)エイベリス点眼液/エイベリスミニ点眼液 適正使用ガイド 6 ■重大な副作用 嚢胞様黄斑浮腫を含む黄斑浮腫
- 2)エイベリス点眼液/エイベリスミニ点眼液 適正使用ガイド 5‐(1)‐① 患者さんの状態に関する確認事項
- 【関連するQ&A】
[2023/05 更新]
投与に注意が必要な患者として、虹彩炎、ぶどう膜炎等の眼炎症性疾患のある患者さんが設定された理由を教えてください。
エイベリス点眼液の国内臨床試験において、安全性解析対象となった総症例267例のうち、眼炎症に関連する副作用として、虹彩炎が4例(1.5%)、前房内細胞が5例(1.9%)に認められました。虹彩炎やぶどう膜炎等の眼炎症性疾患のある患者さんでは、エイベリス点眼液・エイベリスミニ点眼液(エイベリス類)の投与により眼炎症が悪化する可能性があるため投与に注意が必要な患者として設定しました1)。
エイベリス点眼液の承認時、市販直後調査および特定使用成績調査の中間集計における副作用発現状況はこちら(安全性情報)をご覧ください。
- 参考資料
-
- 1)エイベリス点眼液/エイベリスミニ点眼液 適正使用ガイド 6 ■注意を要する副作用 虹彩炎等の眼炎症性疾患
[2023/05 更新]
妊婦へ投与できますか?
エイベリス点眼液の臨床試験では、妊婦又は妊娠している可能性のある女性は投与対象から除外されており使用経験がなく、安全性は十分検討されていません。治療上の有益性が危険性を上回ると判断される場合にのみ投与してください。
エイベリス点眼液・エイベリスミニ点眼液(エイベリス類)を投与される場合には、点眼液の全身への移行が最小限になるよう、点眼後の涙のう部圧迫および閉瞼をご指導ください。
なお、生殖発生毒性試験では妊娠ウサギに皮下投与した場合、0.8mg/kg/日(臨床用量※の40,000倍)では死亡胚胎児数、着床後胚損失率の高値、生存胎児数及び胎児生存率の低値がみられています【参考】。
※エイベリス類を60 kgの患者の両眼に1回1滴(30µL)を点眼投与したときの投与量(0.02µg/kg/日)
- 【参考】
- 生殖発生毒性試験1)
-
試験項目 動物種 投与経路 ① 投与期間
② 投与量生殖発生に関する主な所見 無毒性量 [試験項目]受胎能および着床までの初期胚発生 [動物種]ラット [投与経路]皮下 [① 投与期間、② 投与量] -
- ①(雄)交配前4週間~剖検前日(合計6週間)
- (雌)交配前2週間~妊娠6日
- ②0.01, 0.1, 1mg/kg/日
[生殖発生に関する主な所見] - 1mg/kg/日:
- 軟便(生殖能への影響なし)
[無毒性量] - 一般毒性(雌雄):
- 0.1mg/kg/日
- 生殖能:
- 1mg/kg/日
[試験項目]胚・胎児発生 [動物種]ラット [投与経路]皮下 [① 投与期間、② 投与量] - ①妊娠6日~17日
- ②0.01, 0.1, 1mg/kg/日
[生殖発生に関する主な所見] - 母動物及び胎児への影響なし
[無毒性量] - 一般毒性(母動物):
- 1mg/kg/日
- 胚・胎児発生:
- 1mg/kg/日
[動物種]ウサギ [投与経路]皮下 [① 投与期間、② 投与量] - ①妊娠6日~18日
- ②0.008, 0.08, 0.8mg/kg/日
[生殖発生に関する主な所見] - 0.8mg/kg/日:
- (母動物)虹彩充血
- (胎児)死亡胚・胎児数及び着床後胚損失率の高値、生存胎児数及び胎児生存率の低値
[無毒性量] - 一般毒性(母動物):
- 0.08mg/kg/日
- 胚・胎児発生:
- 0.08mg/kg/日
-
- 血液-胎盤関門通過性2)
- 雌性ラット(妊娠18日)に14C-オミデネパグ イソプロピルを0.03mg/kgの用量で単回皮下投与したとき、母体の血漿中放射能濃度は投与後30分にCmaxとなった後減少したが、羊水及び胎児中に放射能は認められなかったことから、オミデネパグ及びその代謝物の胎盤通過性及び胎児分布はほとんどないと考えられた。
- 参考資料
-
- 1)エイベリス点眼液/エイベリスミニ点眼液 インタビューフォーム Ⅸ-2.-(5) 生殖発生毒性試験の項
- 2)エイベリス点眼液/エイベリスミニ点眼液 インタビューフォーム Ⅶ-5.-(2) 血液-胎盤関門通過性の項
[2023/05 更新]
授乳婦へ投与できますか?
エイベリス点眼液・エイベリスミニ点眼液(エイベリス類)の授乳中の女性への投与は、治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討してください。乳児への影響が懸念される場合には授乳を中止し、人工母乳に切り替えてください。授乳を継続する場合には、点眼液の全身への移行が最小限になるよう、点眼後の涙のう部圧迫および閉瞼をご指導ください。
なお、動物実験(ラット、皮下投与)で、乳汁中への移行は認められませんでした【参考】が、本剤の臨床試験では授乳中の女性は投与対象から除外されており、ヒトにおける乳汁中への移行は不明であるなど、オミデネパグの乳汁を介した哺乳児への安全性は十分検討されていません。
- 【参考】
- 乳汁への移行性1)
- 授乳期の雌性ラットに14C-オミデネパグ イソプロピルを0.03 mg/kgの用量で単回皮下投与したとき、血漿中放射能濃度は投与後30分にCmaxとなった後減少したが、投与後24時間までの全ての点で乳汁中に放射能は認められなかったことから、乳汁中への排泄はほとんどないと考えられた。
- 参考資料
-
- 1)エイベリス点眼液/エイベリスミニ点眼液 インタビューフォーム Ⅶ-5.-(3) 乳汁への移行性の項
[2023/05 更新]
小児等(新生児、乳児、幼児、小児)へ投与できますか?
エイベリス点眼液の臨床試験は20歳以上を対象にしており、エイベリス点眼液・エイベリスミニ点眼液(エイベリス類)については、小児等を対象とした臨床試験は実施しておらず安全性は確立していません。治療上の有益性が危険性を上回ると判断される場合にのみ投与してください。
投与される場合には、点眼液の全身への移行が最小限になるよう、点眼後の涙のう部圧迫および閉瞼をご指導ください。
※年齢区分(おおよその目安)
小児:7歳以上、15歳未満の児、幼児:1歳以上、7歳未満の児、乳児:生後4週以上、1歳未満の児、新生児:出生後4週未満の児、低出生体重児:出生時の体重が2500g未満の児
小児緑内障の治療
緑内障診療ガイドライン第5版 第8章 緑内障の病型別治療1)では、Ⅲ小児緑内障の一病型である1.原発先天緑内障の治療について、『治療の第一選択は手術治療である(1B※)。』、また『薬物治療は周術期ないし手術治療後の補助手段として行われる(1B※)。』としている。加えて、1.-2)薬物治療の項には『どの薬物も乳幼児・小児における安全性および効果についてのデータは確立していないことを忘れてはならない。』と記載している。
※【推奨の強さ】1:強く推奨する、2:弱く推奨する(提案する)
【エビデンスの強さ】A(強):効果の推定値に強く確信がある、B(中):効果の推定値に中程度の確信がある、C(弱):効果の推定値に対する確信は限定的である、D(とても弱い):効果の推定値がほとんど確信できない
- 参考資料
-
- 1)日本緑内障学会緑内障診療ガイドライン改訂委員会:日本眼科学会雑誌 126,85(2022)【66595】
- 【関連するQ&A】
[2023/05 更新]
安全性
タフルプロストを投与中の患者さんに禁忌である理由を教えてください。
エイベリス点眼液0.002%・エイベリスミニ点眼液0.002%(エイベリス類)とタフルプロストの併用経験はありませんが、エイベリス類より高濃度(0.003%、0.01%、0.03%)のオミデネパグ イソプロピル点眼液を0.0015%タフルプロスト点眼液と併用投与した海外の臨床試験において、投与中止を要するような中等度以上の羞明及び虹彩炎等の眼炎症が高頻度に認められました1)。また、サルを用いた非臨床試験において、エイベリス点眼液0.002%及び0.0015%タフルプロスト点眼液を併用投与したときの前房内フレア値は、エイベリス点眼液0.002%単独投与と比べて高くなる傾向がみられました2)。
以上のことから、エイベリス類とタフルプロストを併用した場合、眼炎症の発現リスクが増大する可能性が否定できないため禁忌としました。なお、禁忌の対象は眼単位ではなく患者単位ですのでご注意ください。片眼にのみタフルプロストを使用されている患者で、その対側眼にエイベリス類を投与することは禁忌に該当します3)。
注)本剤が承認されている濃度は0.002%です。
- 参考資料
-
- 1)エイベリス点眼液/エイベリスミニ点眼液 適正使用ガイド 7-(3) タフルプロスト併用投与禁忌の根拠となった試験
- 2)エイベリス点眼液/エイベリスミニ点眼液 適正使用ガイド 8-1) オミデネパグ イソプロピルとタフルプロスト併用時の眼炎症リスクの検討(サル)
- 3)エイベリス点眼液/エイベリスミニ点眼液 適正使用ガイド 5-(1)-② 他の緑内障・高眼圧症治療薬を併用使用する患者さんへの注意事項
[2023/05 更新]
タフルプロストを除く緑内障・高眼圧症治療薬投与中の患者さんに併用注意である理由を教えてください。
エイベリス点眼液と0.5%チモロールマレイン酸塩点眼液との併用時の安全性を検討した第Ⅲ相長期投与試験において、眼障害に分類される副作用の発現割合は、本剤単独群の38.8%(33/85例)と比べて併用群では65.0%(26/40例)と高く、中でも両群で最も高頻度に認められた結膜充血は、本剤単独群の16.5%(14/85例)と比べて併用群では42.5%(17/40例)と発現頻度の上昇が認められました。
エイベリス点眼液とチモロールマレイン酸塩点眼液以外の他の緑内障・高眼圧症治療薬との併用経験はありませんが、併用により結膜充血等の眼炎症性副作用の発現頻度が上昇する可能性があるため、エイベリス点眼液・エイベリスミニ点眼液(エイベリス類)と緑内障・高眼圧症治療薬(併用禁忌のタフルプロストは除く)との併用に際しては十分に注意してください。
特に、タフルプロストを除くFP受容体作動薬(ラタノプロスト、トラボプロスト、ビマトプロスト)と併用される場合は、類薬のタフルプロストとの併用が禁忌となっていますので、ヒトでの使用経験が十分に集積されるまでは、特に注意深く経過観察してください1)2)。サルを用いた非臨床試験において、タフルプロスト以外のFP受容体作動薬との併用時の眼炎症リスクの検討を行ったところ、前房内フレア値は、エイベリス点眼液及び0.0015%タフルプロスト点眼液を併用投与したときと同様に、エイベリス点眼液単独投与と比べて高くなる傾向がみられました3)。他のFP受容体作動薬においても併用による眼炎症リスク上昇の可能性は否定できません。
- 参考資料
-
- 1)エイベリス点眼液/エイベリスミニ点眼液 適正使用ガイド 5-(1)-② 他の緑内障・高眼圧症治療薬を併用使用する患者さんへの注意事項
- 2)エイベリス点眼液/エイベリスミニ点眼液 適正使用ガイド 7-(4) チモロールマレイン酸塩との併用例で結膜充血等の眼炎症性副作用の発現頻度の上昇が認められた臨床試験
- 3)エイベリス点眼液/エイベリスミニ点眼液 適正使用ガイド 8-2) タフルプロスト以外のFP受容体作動薬との併用時の眼炎症リスクの検討(サル)
[2023/05 更新]
嚢胞様黄斑浮腫を含む黄斑浮腫が重大な副作用に設定された理由を教えてください。黄斑浮腫についてどのような注意が必要ですか?
エイベリス点眼液の国内臨床試験において、安全性解析対象となった総症例267例のうち本剤との因果関係を問わない有害事象としての黄斑浮腫(嚢胞様黄斑浮腫を含む)が16例(6.0%)、そのうち、本剤との因果関係が否定できない副作用として14例(5.2%)に認められました1)。本剤投与後に認められた黄斑浮腫はほとんどの場合で視力低下や視力障害(見えづらい等)を伴っており、早期に適切な処置を行う必要があるため、重大な副作用に設定しました。
エイベリス点眼液の承認時、市販直後調査および特定使用成績調査の中間集計における副作用発現状況はこちら(安全性情報)をご覧ください。
- 【参考】
- 国内臨床試験での有害事象及び副作用発現状況1)2)
- 黄斑浮腫(有害事象)の16例は第Ⅲ相長期投与試験において認められた。
安全性解析対象症例を有水晶体眼患者(215例)と眼内レンズ挿入眼患者(52例)で分けたときの黄斑浮腫(副作用)及び黄斑浮腫(有害事象)の発現状況は下表のとおりであった。黄斑浮腫(副作用)はいずれも眼内レンズ挿入眼患者において認められ、有水晶体眼患者では本剤との因果関係の否定された黄斑浮腫が1例認められた。
| 有水晶体眼患者 (215例) |
眼内レンズ挿入眼患者 (52例) |
|
|---|---|---|
| 黄斑浮腫(副作用)発現例数(%) | 0例(0.0%) | 14例(26.9%) |
| 黄斑浮腫(有害事象)発現例数(%) | 1例(0.5%) | 15例(28.8%) |
黄斑浮腫(副作用の14例)は、いずれも非重篤、重症度は軽度5例、中等度9例、1例を除きすべての症例で視力低下や視力障害(見えづらい等)を伴い、非ステロイド性抗炎症剤やステロイド剤等の点眼等による治療により、全例で回復/軽快した。
なお、発現の好発時期は認められなかった。
- 市販後(発売~2022年9月20日)における発現状況(有水晶体眼患者)1)
- ●黄斑浮腫の発現までの期間
市販後に発現が認められた106例の発現時期は、最短で投与5日目、最長で投与869日目、平均日数は183.6±195.4日(平均±標準偏差)、中央値は105.0日だった。52例(49.1%)は投与開始から120日以内に発現がみられた。
●黄斑浮腫の転帰
106例中60例が「回復」、23例が「軽快」、5例が「未回復※」、18例が「不明」であった。
回復した症例(回復日が特定できたもの)の回復までの期間は、黄斑浮腫の発現後、最短で11日、最長で155日、平均日数は61.5±38.0日(平均±標準偏差)、中央値は48.5日だった。※初回報告時に「未回復」と報告され、それ以降に転帰が確認できなかったものも含む
黄斑浮腫についてどのような注意が必要ですか?
嚢胞様黄斑浮腫を含む黄斑浮腫を発現した眼では多くの場合、視力低下や見えづらい等の自覚症状を伴います。これらの症状が認められた場合は、直ちに受診するよう患者さんを指導してください。また発現の好発時期は認められなかったことから、継続的な注意観察が必要になります。診察時には、視野の中心が見えづらい、視力低下といった患者さんの自覚症状を確認し、視力検査や光干渉断層計(OCT)検査等を実施してください。黄斑浮腫が確認された場合は、エイベリス点眼液・エイベリスミニ点眼液(エイベリス類)の投与を中止し、適切な処置を行ってください。浮腫が慢性化すると徐々に網膜の神経細胞が障害を受け、視力の改善が遅れる、あるいは完全な回復が認められないことがありますので、早期の発見及び治療開始が大切です。
- 参考資料
-
- 1)エイベリス点眼液/エイベリスミニ点眼液 適正使用ガイド 6 ■重大な副作用 嚢胞様黄斑浮腫を含む黄斑浮腫
- 2)エイベリス点眼液/エイベリスミニ点眼液 インタビューフォーム Ⅷ-8.-(1) 重大な副作用と初期症状の項
[2023/05 更新]
服薬指導
エイベリス コンタクトレンズを装用したまま使用してもよいですか?
コンタクトレンズ(CL)装用中の点眼可否は一概に決められるものではありません。眼の状態を十分に観察し、アドヒアランス等も考慮して、患者さんごとにエイベリス点眼液の点眼可否をご判断ください。
原則的にはハード・ソフトを問わず、いずれのCLもはずして点眼し、少なくとも5~10分間の間隔をあけて再装用することが望まれます。ただし、一般的には眼表面に疾患がなく、CLを装用できる状態であれば、ハードCL(酸素透過性CLを含む)装用者が使用する場合は、そのまま点眼可能と言われています。
エイベリス点眼液は1日1回点眼ですので、CL装用中の点眼を避けるための工夫として、朝CLを装用する前に点眼するか、あるいは、夜CLをはずした後に点眼するといった方法があります。
- 【注意】
- 点眼可否を判断する基準が定められていない現状では、点眼剤の剤型やCLの種類だけで決めることは難しく、製薬会社、CL販売会社などによっても見解が異なる場合があります。
[2023/05 更新]
エイベリスミニ コンタクトレンズを装用したまま使用してもよいですか?
エイベリスミニ点眼液は防腐剤を含有していませんが、主薬や添加剤のコンタクトレンズ(CL)に対する影響は検討していません。そのため、眼の状態を十分に観察し、アドヒアランス等も考慮して、患者さんごとに点眼可否をご判断ください。
原則的にはハード・ソフトを問わず、いずれのCLもはずして点眼し、少なくとも5~10分間の間隔をあけて再装用することが望まれます。ただし、一般的には眼表面に疾患がなく、CLを装用できる状態であれば、ハードCL(酸素透過性CLを含む)装用者が使用する場合は、そのまま点眼可能と言われています。
エイベリスミニ点眼液は、エイベリス点眼液と同じく1日1回点眼ですので、朝CLを装用する前に点眼する、あるいは、夜CLをはずした後に点眼することも一法です。
- 【注意】
- 点眼可否を判断する基準が定められていない現状では、CLの種類だけで決めることは難しく、CL販売会社などによっても見解が異なる場合があります。
[2023/05 作成]
エイベリスミニ 開封時、点眼せずに1~2滴捨てる理由を教えてください。
容器を開封した時に生じるプラスチック破片が、容器の開封口に付着している可能性があります。
点眼時の破片の混入を回避するため、エイベリスミニ点眼液の開封時は最初の1~2滴を捨てるよう注意喚起しています。
[2023/05 作成]
エイベリスミニ 1本で両眼に点眼できますか?
エイベリスミニ点眼液は1本で両眼に点眼可能です。
なお、エイベリスミニ点眼液は防腐剤を含有していないシングルユース(1回使い捨て)タイプの点眼液です。余った液は残さず、すみやかに破棄してください。
[2023/05 作成]
その他、点眼剤の全般的な服薬指導についてはこちらをご覧ください。
製品に関するお問い合わせ(医療関係者の皆様)
製品情報センター:0120-921-839
※上記フリーコールがご利用いただけない場合:06-6321-7056
受付時間:9:00~17:00(土、日、祝日を除く)
お問い合わせフォームはこちら